Entwicklung von Medizinproduktesoftware (SaMD/MDSW)
End-to-End-Entwicklung von Medizinproduktesoftware
| Vom Konzept bis zur Zertifizierung
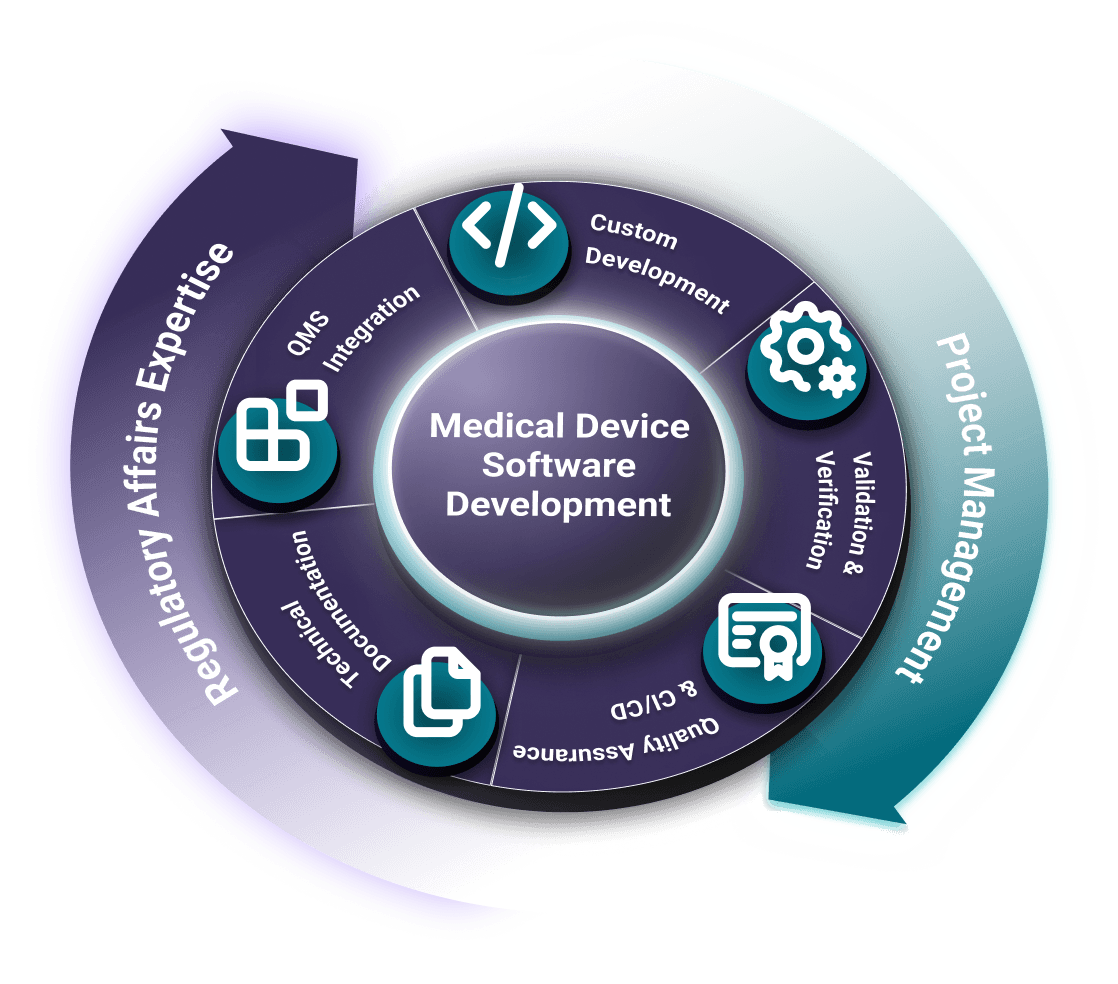
QMLogic ist Ihr zuverlässiger Partner für die Entwicklung von Software für Medizinprodukte (MDSW/SaMD). Wir bieten Ihnen umfassende Unterstützung in den Bereichen Technik, Regulierung und Projektmanagement und stellen sicher, dass Ihre Software für Medizinprodukte sicher und effektiv ist und internationalen Normen und Vorschriften wie IEC 62304, ISO 13485, ISO 14971, FDA 21 CFR und EU MDR entspricht.
Von der Konzeption und dem Design über die Verifizierung und Validierung bis hin zur Einreichung bei den Aufsichtsbehörden und der Überwachung nach dem Inverkehrbringen begleiten wir Medizinproduktehersteller durch den gesamten Softwareentwicklungszyklus. Unsere Lösungen sind stets auditfähig, konform und nahtlos in Ihr Qualitätsmanagementsystem (QMS) integriert.

Entwicklungsdienstleistungen für Medizinproduktesoftware
Wir sind Entwickler aus Leidenschaft. Unser Team erstellt täglich anspruchsvolle Software unter Verwendung modernster Technologien wie React.js, Next.js, Spring Boot und .NET. Die Entwicklung ist nichts, was wir auslagern; sie ist unsere Kernkompetenz, die nahtlos mit unserem regulatorischen Wissen integriert ist, um vom ersten Tag an konforme, innovative Lösungen zu schaffen.
- Compliance in jeder Zeile Code
- Entwickler und Regulierungsexperten in einem Team
- IEC 62304-konform durch Design
- Integriert mit ISO 14971 Risikomanagement
- Entworfen mit Cybersicherheit gemäß IEC 81001-5-1
- React, Spring Boot, .NET-Beherrschung
- Moderner Stack, medizinische Sicherheit
Wir entwickeln Software, die auf Ihr Qualitätsmanagementsystem abgestimmt ist und sicherstellt, dass jede Zeile Code Compliance, Effizienz und Geschäftskontinuität unterstützt.
Expertise im Bereich Regulatory Affairs bei der Entwicklung von Medizinproduktesoftware
Unsere Kompetenz im Bereich Regulatory Affairs stellt sicher, dass Ihre Software auditfähig, validiert und konform mit wichtigen Standards ist, darunter:

IEC 62304
Software-Lebenszyklus-Konformität
Definiert die erforderlichen Entwicklungs- und Wartungsprozesse für SaMD/MDSW und gewährleistet Sicherheit, Rückverfolgbarkeit und behördliche Zulassung.

ISO 13485
QMS für medizinische Software
Bietet den Rahmen für das Qualitätsmanagement, um die Softwareentwicklung an globale Standards für Medizinprodukte anzupassen.

ISO 14971
Integration des Risikomanagements
Stellt sicher, dass die Identifizierung, Bewertung und Kontrolle von Risiken in den Software-Lebenszyklus integriert sind, um Patienten und Anwender zu schützen.

ISO 80002-2
Validierung von Computersystemen
Leitet die Validierung von Computersystemen und Software und gewährleistet zuverlässige Leistung und behördliche Akzeptanz.

EU-MDR
Europäische Medizinprodukteverordnung
Legt die Anforderungen für die CE-Kennzeichnung von Medizinproduktesoftware fest, einschließlich Sicherheit, Leistung und Überwachung nach dem Inverkehrbringen.

21 CFR Part 820
US-Konformität
Teil 11 regelt elektronische Aufzeichnungen und Signaturen, während Teil 820 die Konformität des Qualitätssystems für FDA-regulierte Software sicherstellt.

FDA 510(k)
Marktzugangsgenehmigung
Weist die wesentliche Gleichwertigkeit Ihrer Medizinprodukt-Software nach und ermöglicht so den Eintritt in den US-Markt.

ISO/IEC 27001
Informationssicherheit
Bietet einen weltweit anerkannten Rahmen für das Management der Informationssicherheit und stellt sicher, dass Medizinprodukt-Software sensible Gesundheitsdaten schützt.

IEC 81001-5-1
Cybersicherheit für Gesundheitssoftware
Befasst sich speziell mit der Cybersicherheit für Gesundheitssoftware und konzentriert sich auf die sichere Konzeption, Entwicklung und Wartung von Medizinproduktesoftware.
Durch die Kombination von technischem Fachwissen und Regulierungserfahrung unterstützen wir MedTech-Unternehmen dabei:
SaMD mit integrierter Regulierungskonformität zu entwerfen, zu entwickeln und zu validieren
Von Anfang an auditfähige technische Dokumentation zu erstellen
Die EU-MDR-Zertifizierung und FDA-Zulassung zu beschleunigen
Schneller Markteinführung mit einer skalierbaren, konformen und zukunftssicheren Softwarelösung
Unser einzigartiger Ansatz stellt sicher, dass jede Zeile Code nicht nur Ihre Geschäftsziele unterstützt, sondern auch die regulatorischen Rahmenbedingungen, die Ihren Markterfolg bestimmen. Vom Konzept bis zur Zertifizierung helfen wir Ihnen bei der Entwicklung, Erstellung, Validierung und Dokumentation Ihrer SaMD für eine schnellere und reibungslosere Markteinführung.
Warum QMLogic für die Entwicklung von Software für medizinische Geräte?

Nachgewiesene Erfolgsbilanz
Wir haben zahlreiche erfolgreiche und vollständig konforme SaMD-Entwicklungsprojekte durchgeführt, vom ersten Konzept bis zur Überwachung nach dem Inverkehrbringen, sowohl für Start-ups als auch für etablierte MedTech-Unternehmen.
End-to-End-Projektmanagement-Integration
Unsere dedizierten Projektmanagement-Services gewährleisten eine effiziente Koordination, transparente Kommunikation, Meilensteinverfolgung und proaktives Risikomanagement über den gesamten Entwicklungslebenszyklus hinweg.
Regulatorische Expertise in globalen Märkten
Umfassende Kenntnisse der Normen IEC 62304, ISO 13485, ISO 14971, EU MDR und FDA 21 CFR 820 stellen sicher, dass Ihre Software alle erforderlichen regulatorischen und Compliance-Anforderungen weltweit erfüllt.
Qualitätssicherung und Risikomanagement
Jede Entwicklungsphase ist eng an die Risikomanagementstandards ISO 14971 und die Cybersicherheitsstandards IEC 81001-5-1 angelehnt, um die Patientensicherheit und den Datenschutz von Grund auf zu gewährleisten.
Anpassbare und skalierbare Lösungen
Ganz gleich, ob Sie ein MVP auf den Markt bringen, auf eine komplexe Plattform skalieren oder neue globale Märkte erschließen möchten – unser Entwicklungs- und Compliance-Ansatz lässt sich flexibel an Ihre sich wandelnden geschäftlichen und technischen Anforderungen anpassen.
QMS-Integration und Digitalisierung
Ihre Softwareentwicklungsprozesse werden nahtlos auf Ihr ISO 13485-konformes Qualitätsmanagementsystem (QMS) abgestimmt. Darüber hinaus bieten wir Unterstützung bei der Implementierung von QMS-Software und der Digitalisierung, um Ihre Abläufe zu modernisieren.
Sind Sie bereit, Ihre Medizinprodukt-Software zu entwickeln?
Ganz gleich, ob Sie ein Start-up sind, das sein erstes SaMD auf den Markt bringt oder ein etablierter Hersteller, der sein Portfolio erweitert – wir helfen Ihnen, die Entwicklung zu beschleunigen und gleichzeitig die Compliance sicherzustellen.
Referenzen | Expertise in der Entwicklung von Medizinproduktesoftware
Vaclav und ich arbeiteten bei Risikomanagementaktivitäten von Medizinprodukteentwicklungsprojekten zusammen. Seine Fähigkeit, Herausforderungen schnell zu erfassen und eine Aufgabe/ein Projekt zu erledigen, ist bemerkenswert. Darüber hinaus ist seine Fähigkeit, Softwarelösungen zur Verbesserung der Projekteffizienz vorzuschlagen und zu entwickeln, lobenswert. Ich halte Vaclav für flexibel, zuverlässig und qualitätsorientiert. Daher hat mir die Zusammenarbeit mit Vaclav sehr viel Spaß gemacht und ich freue mich darauf, wieder mit ihm zusammenzuarbeiten.
Ich hatte das Vergnügen, mit Vaclav während unserer Entwicklung eines Medizinprodukts für Merck zusammenzuarbeiten. Ich empfand Vaclav als sehr professionell und engagiert. Seine Liebe zum Detail und sein technisches/medizinisches Wissen brachten immens wertvolle Inputs in das Projekt ein. Die Zusammenarbeit mit Vaclav war wirklich ein Vergnügen und ich kann ihn wärmstens empfehlen.
Ihr zuverlässiger Partner in allen Phasen des Lebenszyklus von Medizinproduktesoftware
Medizinprodukteverordnung
Wirksamkeit und Machbarkeit sind ebenso wichtig wie Compliance
Wir verstehen das regulatorische Umfeld. Wir haben Erfahrung in der Umsetzung aller Normen im Zusammenhang mit medizinischer Softwareentwicklung, Cybersicherheit und technischer Dokumentation. Gerne zeigen wir Ihnen in der Praxis, wie wir dieses Fachwissen in reale Lösungen umsetzen können, während wir an Ihrem Medizinprodukt-Softwareprodukt arbeiten – als Entwickler und Projektmanager.
- Reale Lösungen für Ihr Unternehmen
Digitalisierung des Qualitätsmanagements
und Automatisierung für ISO 13485
Bei QMLogic befähigen wir Organisationen, ihre Qualitätsmanagementsysteme (QMS) mit modernsten Automatisierungstools zu revolutionieren. Unsere Expertise umfasst Microsoft SharePoint, Power Platform, Confluence, Jira und maßgeschneiderte Lösungen, die auf spezifische Bedürfnisse zugeschnitten sind.
- Zukunft des Qualitätsmanagements
Kostenlose Beratung erhalten
Fragen Sie alles, was Sie über medizinische Software, CE-Zertifizierung oder MDR wissen müssen.

