Développement de logiciels pour dispositifs médicaux (SaMD/MDSW)
Développement complet de logiciels pour dispositifs médicaux
| De la conception à la certification
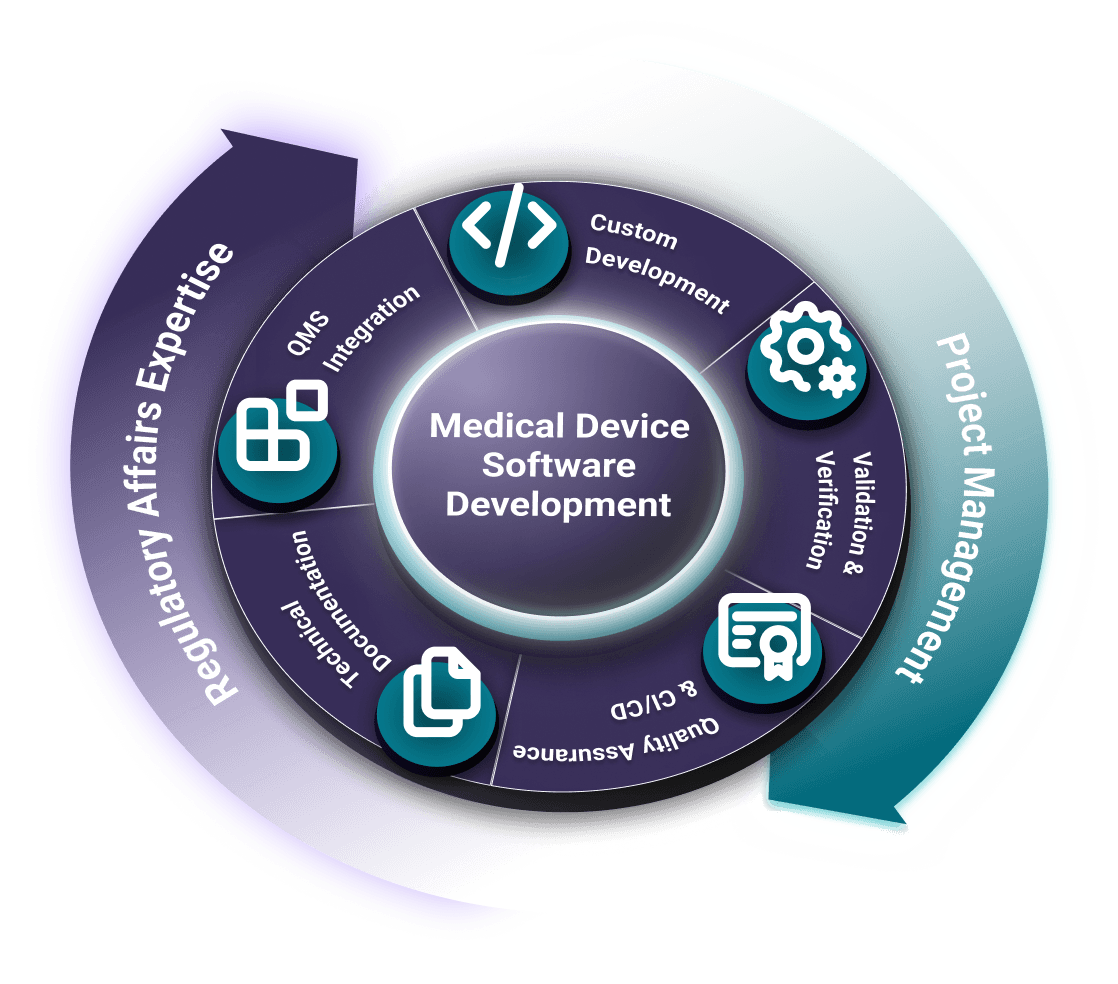
QMLogic est votre partenaire de confiance pour le développement de logiciels pour dispositifs médicaux (MDSW/SaMD). Nous fournissons une assistance technique, réglementaire et de gestion de projet complète, garantissant que votre logiciel pour dispositifs médicaux est sûr, efficace et conforme aux normes et réglementations internationales telles que IEC 62304, ISO 13485, ISO 14971, FDA 21 CFR et EU MDR.
De la conception et du design à la vérification et la validation, en passant par la soumission réglementaire et la surveillance post-commercialisation, we accompagnons les entreprises de dispositifs médicaux tout au long du cycle de vie du développement logiciel. Nos solutions sont toujours prêtes pour les audits, conformes et parfaitement intégrées à votre système de gestion de la qualité (SGQ).

Services de développement de logiciels pour dispositifs médicaux
Nous sommes des développeurs dans l'âme. Notre équipe crée quotidiennement des logiciels sophistiqués à l'aide de technologies de pointe telles que React.js, Next.js, Spring Boot et .NET. Le développement n'est pas une activité que nous sous-traitons ; c'est notre cœur de métier, intégré de manière transparente à notre connaissance de la réglementation afin de créer des solutions conformes et innovantes dès le premier jour.
- Conformité intégrée dans chaque ligne de code
- Développeurs et experts réglementaires au sein d'une même équipe
- Conforme à la norme IEC 62304 dès la conception
- Intégré à la gestion des risques ISO 14971
- Conçu avec la cybersécurité selon la norme IEC 81001-5-1
- Maîtrise de React, Spring Boot et .NET
- Pile moderne, sécurité de niveau médical
Nous concevons des logiciels alignés sur votre système de gestion de la qualité, garantissant que chaque ligne de code favorise la conformité, l'efficacité et la continuité des activités.
Expertise en matière d'affaires réglementaires dans le développement de logiciels pour dispositifs médicaux
Notre expertise en matière réglementaire garantit que votre logiciel est prêt pour l'audit, validé et conforme aux normes clés, notamment :

IEC 62304
Conformité du cycle de vie des logiciels
Définit les processus de développement et de maintenance requis pour les SaMD/MDSW, garantissant la sécurité, la traçabilité et l'approbation réglementaire.

ISO 13485
SMQ pour les logiciels médicaux
Fournit le cadre de gestion de la qualité permettant d'aligner le développement de logiciels sur les normes mondiales relatives aux dispositifs médicaux.

ISO 14971
Intégration de la gestion des risques
Garantit que l'identification, l'évaluation et le contrôle des risques sont intégrés dans le cycle de vie des logiciels, protégeant ainsi les patients et les utilisateurs.

ISO 80002-2
Validation des systèmes informatiques
Guide la validation des systèmes informatiques et des logiciels, garantissant des performances fiables et l'acceptation réglementaire.

EU-MDR
Règlement européen sur les dispositifs médicaux
Définit les exigences relatives au marquage CE des logiciels pour dispositifs médicaux, couvrant la sécurité, les performances et la surveillance après commercialisation.

21 CFR Part 820
Conformité aux normes américaines
La partie 11 régit les enregistrements et signatures électroniques, tandis que la partie 820 garantit la conformité du système qualité pour les logiciels réglementés par la FDA.

FDA 510(k)
Autorisation d'accès au marché
Démontre l'équivalence substantielle de votre logiciel pour dispositifs médicaux, permettant son entrée sur le marché américain.

ISO/IEC 27001
Sécurité de l'information
Fournit un cadre mondialement reconnu pour la gestion de la sécurité de l'information, garantissant que les logiciels pour dispositifs médicaux protègent les données de santé sensibles.

IEC 81001-5-1
Cybersécurité des logiciels de santé
Traite spécifiquement de la cybersécurité des logiciels de santé, en mettant l'accent sur la conception, le développement et la maintenance sécurisés des logiciels médicaux.
En combinant notre expertise technique et notre maîtrise des réglementations, nous aidons les entreprises de technologie médicale à :
Concevoir, construire et valider des SaMD conformes aux réglementations
Élaborer dès le départ une documentation technique prête pour l'audit
Accélérer la certification MDR de l'UE et l'autorisation de la FDA
Lancer plus rapidement leurs produits grâce à une solution logicielle évolutive, conforme et pérenne
Notre approche unique garantit que chaque ligne de code soutient non seulement vos objectifs commerciaux, mais aussi le cadre réglementaire qui régit votre succès sur le marché. De la conception à la certification, nous vous aidons à concevoir, construire, valider et documenter votre SaMD pour un lancement plus rapide et plus fluide sur le marché.
Pourquoi choisir QMLogic pour le développement de logiciels pour dispositifs médicaux ?

Une expérience éprouvée
Nous avons mené à bien de nombreux projets de développement de SaMD, de la conception initiale à la surveillance post-commercialisation, pour des start-ups et des entreprises MedTech établies.
Intégration de la gestion de projet de bout en bout
Nos services de gestion de projet dédiés garantissent une coordination efficace, une communication transparente, un suivi des étapes clés et une gestion proactive des risques tout au long du cycle de développement.
Expertise réglementaire sur les marchés mondiaux
Notre connaissance approfondie des normes IEC 62304, ISO 13485, ISO 14971, EU MDR et FDA 21 CFR 820 garantit que votre logiciel répond à toutes les exigences réglementaires et de conformité nécessaires à l'échelle mondiale.
Cybersécurité et gestion des risques
Chaque phase du développement est étroitement alignée sur les normes ISO 14971 en matière de gestion des risques et IEC 81001-5-1 en matière de cybersécurité, garantissant ainsi la sécurité des patients et la protection des données dès le départ.
Solutions personnalisables et évolutives
Que vous lanciez un MVP, que vous passiez à une plateforme complexe ou que vous pénétriez de nouveaux marchés mondiaux, notre approche en matière de développement et de conformité peut s'adapter de manière flexible pour répondre à l'évolution de vos besoins commerciaux et techniques.
Intégration et numérisation du SMQ
Vos processus de développement logiciel s'aligneront parfaitement sur votre système de gestion de la qualité (QMS) conforme à la norme ISO 13485. Nous proposons également une assistance pour la mise en œuvre et la numérisation du logiciel QMS afin de moderniser vos opérations.
Prêt à développer votre logiciel pour dispositifs médicaux ?
Que vous soyez une start-up lançant son premier SaMD ou un fabricant établi élargissant son portefeuille, nous vous aidons à accélérer le développement tout en garantissant la conformité.
samd-development.testimonials.title
Vaclav et moi avons travaillé ensemble sur les activités de gestion des risques de projets de développement de dispositifs médicaux. Sa capacité à saisir rapidement les défis et à mener à bien une tâche/un projet est remarquable. De plus, sa capacité à proposer et à développer des solutions logicielles pour améliorer l'efficacité des projets est louable. Je trouve Vaclav flexible, fiable et axé sur la qualité. Par conséquent, j'ai vraiment apprécié de travailler avec Vaclav et j'ai hâte de m'associer à lui à nouveau.
J'ai eu le plaisir de travailler avec Vaclav lors de notre développement d'un produit médical pour Merck. J'ai trouvé Vaclav très professionnel et dévoué. Son souci du détail et ses connaissances techniques/médicales ont apporté des contributions d'une immense valeur au projet. Collaborer avec Vaclav a été un réel plaisir et je le recommande vivement.
Votre partenaire de confiance dans toutes les étapes du cycle de vie des logiciels pour dispositifs médicaux
Réglementation des dispositifs médicaux
L'efficacité et la faisabilité sont aussi importantes que la conformité
Nous comprenons l'environnement réglementaire. Nous avons l'expérience de la mise en œuvre de toutes les normes relatives au développement de logiciels médicaux, à la cybersécurité et à la documentation technique. Nous serions ravis de vous démontrer en pratique comment nous pouvons traduire cette expertise en solutions réelles tout en travaillant sur votre produit logiciel pour dispositifs médicaux - en tant que développeurs et gestionnaires de projet.
- Solutions concrètes pour votre organisation
Numérisation de la gestion de la qualité
et automatisation pour l'ISO 13485
Chez QMLogic, nous permettons aux organisations de révolutionner leurs systèmes de gestion de la qualité (SMQ) grâce à des outils d'automatisation de pointe. Notre expertise s'étend à Microsoft SharePoint, Power Platform, Confluence, Jira et aux solutions personnalisées adaptées à des besoins spécifiques.
- L'avenir de la gestion de la qualité
Obtenez des conseils gratuitement
Posez toutes vos questions sur les logiciels médicaux, la certification CE ou le MDR.

